FDA, Nabız Oksimetre Performansını Artırmak İçin Yeni Kılavuzlar Yayınlıyor
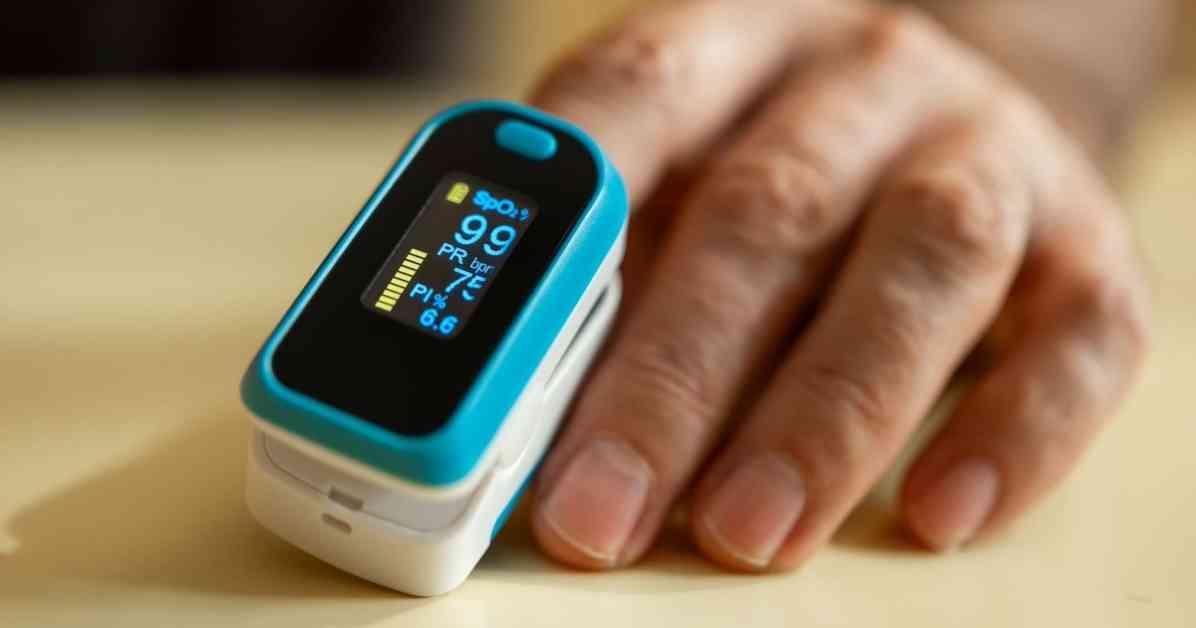
Gıda ve İlaç İdaresi (FDA), nabız oksimetrelerin doğruluğunu ve performansını artırmayı amaçlayan yeni taslak kılavuzları yayınladı ve bu kılavuzlarda cilt tonlarının çeşitliliğinin göz önünde bulundurulduğunu belirtti.
Taslak kılavuz, Tıbbi Amaçlarla Kullanılan Nabız Oksimetreleri – Klinik ve Klinik Dışı Performans Testleri, Etiketleme ve Önceden Pazara Gönderim Önerileri başlığını taşıyor ve genellikle hastane ortamlarında veya doktor ofislerinde kullanılan tıbbi amaçlarla kullanılan nabız oksimetrelerini kapsıyor.
FDA’ya göre, nabız oksimetre performansında, daha açık ve daha koyu cilt pigmentasyonuna sahip bireyler arasında doğruluk farklılıkları olabilir.
Kılavuz, nabız oksimetre üreticilerine, tıbbi amaçlarla kullanılan nabız oksimetre cihazlarının klinik çalışma tasarımını ve doğrulama çabalarını geliştirmeye yardımcı olacak klinik veri toplama yöntemleri konusunda öneriler sunuyor ve cihazın performansının cilt pigmentasyon aralığında nasıl değerlendirileceğini belirliyor.
Öneriler, bu cihazlar için hedef kullanıcı popülasyonunun daha temsilci bir çalışmasının yapılmasını amaçlıyor.
FDA’nın taslak önerilerinin ana unsurları şunları içeriyor:
–
Cilt pigmentasyon aralığında cihaz performans doğruluğunu değerlendirmek için klinik veri toplamak.
–
Klinik çalışma katılımcılarının sayısını artırmak.
–
Klinik katılımcıların cilt tonunu daha standart bir şekilde değerlendirmek ve cihaz performansını cilt pigmentasyonuna göre doğru bir şekilde değerlendirmek için subjektif (Monk Cilt Tonu Ölçeği) ve objektif (bireysel tipoloji açısının hesaplanması) yöntemler kullanmak.
–
Yeni bir pazara sunumunda performans doğruluğu gösterilmişse, cihazın farklı cilt pigmentasyon grupları arasında eşit performans sergilediğini ve tıbbi amaçlar için tasarlandığını belirten dikkate değer bir etiket beyanı içermek.
“Bu taslak kılavuz, FDA’nın yüksek kaliteli, güvenli ve etkili tıbbi cihazların gelişimini kolaylaştırmaya yönelik genel taahhüdüyle uyumludur,” FDA’nın Cihazlar ve Radyolojik Sağlık Merkezi direktörü Dr. Michelle Tarver, bir açıklamada belirtti.
“Taslak önerilerimiz, bir bireyin cilt pigmentasyonuna bağlı olarak nabız oksimetrelerin farklı performanslarına ilişkin endişeleri ele almak için mevcut en iyi bilime dayanmaktadır.”
Taslak kılavuz, genel sağlık ürünleri olarak satılan nabız oksimetreleri veya spor/havacılık ürünleri için geçerli değildir, çünkü bu ürünler FDA tarafından halka sunulmadan önce incelenmez veya değerlendirilmez.
FDA, taslak kılavuz üzerine yorumları yayımlanmasının ardından 60 gün içinde istemektedir. Ajans, kılavuzu son hale getirmeden önce yorumları gözden geçirecek ve dikkate alacaktır.